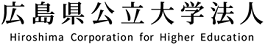本文
【生命環境学部】 ゲノム・ストレス(放射線)による上皮分裂軸制御異常の分子機構を解明 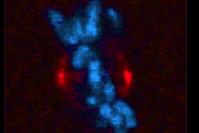
放射線治療後に癌が再発するのはなぜか?紫外線を浴びた肌のキメが失われるのはなぜか?私たちにも身近な問題の解決に迫る成果です。
生命科学科の達家教授の研究室では、上皮ホメオスタシス維持に重要な基底膜上での分裂軸制御がゲノム・ストレス(放射線)によって乱れることを見つけました。また、この制御異常には、シグナル分子であるRhoGDIβの変様型が出現することを突き止めました。
成果はJournal of Cellular Physiologyに印刷中であり、オンライン版で2019年1月16日に印刷前公開されています。
大学院前期課程(修士)2年生の土井捺実さん、1年生の國松優喜さんと藤裏航平さん、卒業研究配属4年生の戸賀里飛郎さんと三奈木健司さんと達家雅明教授たちは、上皮細胞の分裂軸制御がゲノム・ストレス(放射線)によって乱れること、また、その乱れの原因が、シグナル分子であるRhoGDIβの変様型の出現による分裂軸制御因子(Cdc42)の阻害に起因していることを見つけました。Cdc42阻害は、分裂軸制御の異常を生み、上皮組織でのアポトーシス誘導性補償増殖を促し、上皮組織の正常な構築に影響を与えることが知られています。
この研究は、ゲノム・ストレス(放射線)に曝されてアポトーシスで死滅した細胞の中で生存し、再増殖(再生)した細胞では、ゲノム・ストレス暴露の記憶が、変様型RhoGDIβ分子の発現という形でメモリーされており、その後の細胞集団の行く末に影響を与えていることを示します。
この成果は、これまで不明の点の多かった放射線(あるいは、化学療法や分子標的)治療後の癌組織における再発の問題や、上皮組織におけるゲノム・ストレス被曝(例えば、紫外線を受けた皮膚上皮細胞とか、発癌剤に曝された消化器上皮粘膜細胞)でのホメオスタシスの乱れのメカニズム解明に貢献します。
現在、達家研究室では、RhoGDIβに関する癌の基礎研究を進めると共に、特に、コスメティック研究にもこの成果を応用しつつあります。ヒトの皮膚組織の基底膜における幹細胞の分裂軸制御に注目して、
- 紫外線によって出現する変様型RhoGDIβ分子が、美肌を損なう原因になっているのではないか?
- 変様型RhoGDIβ分子の発現を抑制すれば、美肌効果が期待出来るのではないか?
- 変様型RhoGDIβ分子の発現抑制の活性を持つ天然物や合成化合物には、分裂軸の正常化を通じた美肌効果が期待されるのではないか?
なお、本研究は文科省の科研費(17K00556)や、県立広島大学重点研究事業学際的・先端的研究(S)の助成を受けて行われました。
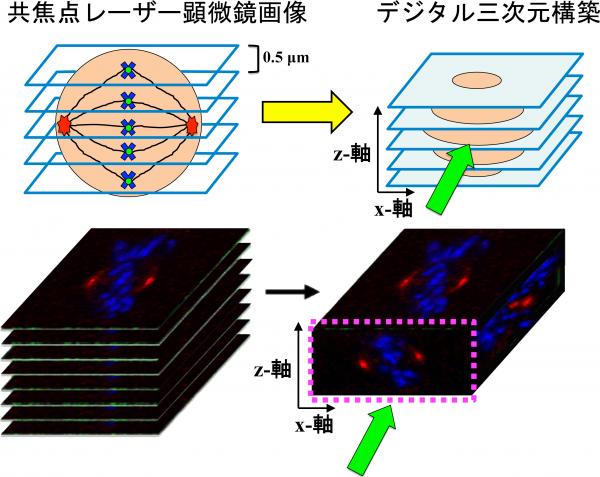
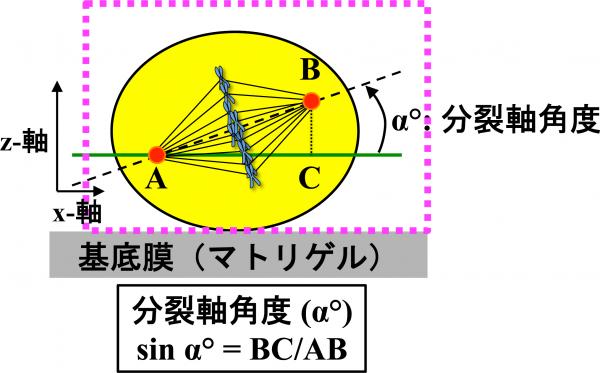 方法:共焦点顕微鏡で撮影した画像を重ねて詳細な3次元モデルを構築し、細胞分裂の軸の傾きを計測します。
方法:共焦点顕微鏡で撮影した画像を重ねて詳細な3次元モデルを構築し、細胞分裂の軸の傾きを計測します。
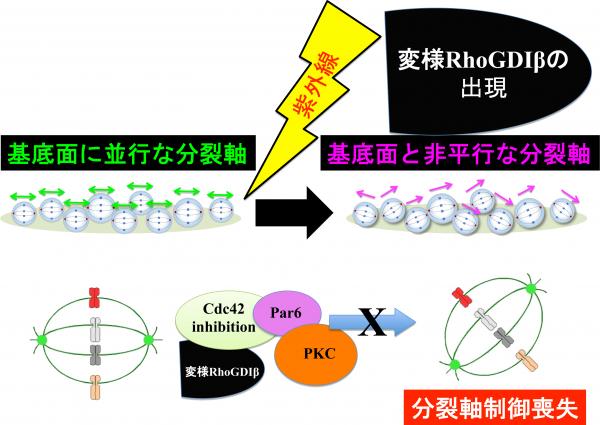 結論:ゲノムストレス応答分子であるRhoGDIβが放射線などにより変化することで、過去のストレスが記憶され、上皮組織細胞の「揃い方」が乱れることを世界で初めて示しました。
結論:ゲノムストレス応答分子であるRhoGDIβが放射線などにより変化することで、過去のストレスが記憶され、上皮組織細胞の「揃い方」が乱れることを世界で初めて示しました。 大学概要
大学概要
 学部・大学院・専攻科
学部・大学院・専攻科
 学生生活・就職支援
学生生活・就職支援
 研究・地域連携・国際交流
研究・地域連携・国際交流
 入試情報
入試情報