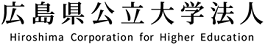本文
【看護学コース】田口勝敏ゼミの紹介
田口研究室での取り組み
〔取り組みテーマ: レビー小体病における神経変性メカニズムの解析〕
【学術的背景】
現在、日本は高度高齢社会にあり、加齢に伴って発症数が増える様々な神経変性疾患の治療法開発は、当該医学分野における重要課題の一つであります。当研究室が取り組んでいるパーキンソン病(PD)もまた近年増加傾向にあり、治療法の開発と共に、その発症メカニズムの解明が急務です。レビー小体病と総称されるPDやレビー小体型認知症(DLB)では、脳内に「レビー小体」という異常な細胞内凝集体が形成され、病期の進行と共に多くの神経細胞が変性・脱落してしまいます。レビー小体は主にαシヌクレイン(αSyn)というタンパク質で構成されており、その遺伝子のミスセンス変異や重複が家族性PDの発症につながることから、神経変性メカニズムを理解する上で非常に重要な分子であると位置付けられています。PD最初期ではレビー小体の形成は、嗅球や延髄において観察され、病期の進行に伴って、下部脳幹から大脳皮質に向かって上行性に拡大することが知られています。近年、この脳内変性領域拡大の分子的基盤として「プリオン様細胞間伝播」の存在が注目されています(下図1)。
高分子化したαSynが神経細胞内へ取り込まれると、これが重合核となり、細胞内に内在的に発現するαSynが更に重合を開始し、最終的にはレビー小体の形成に繋がると考えられています。以上のことから、この重合核は「シード」と呼ばれています。しかしながら、レビー小体やシードの形成、およびシードの細胞間伝播プロセスについては、未だ不明な点が数多く残されている状況にあります。
我々の研究では、生体脳内においてレビー小体様凝集体の形成やシードの細胞間伝播を再現させ、これらのプロセスに関与する分子群を生化学的あるいは機能形態学的手法によって同定・機能解析し、レビー小体形成プロセスの根底にある分子メカニズムの解明を目的としています。神経変性プロセスの分子機序解明を通して、創薬を含む効果的な神経保護ストラテジーの構築を目指しています。
【現在進めている研究】
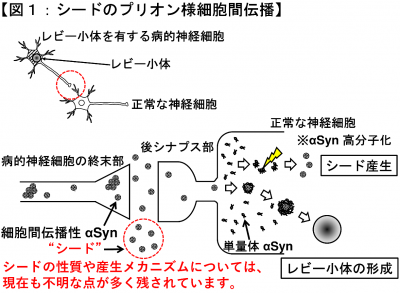
近年、初代培養神経細胞を用いた我々の基礎研究により、シードを構成するαSynの一部が分子内切断されており、この切断がSENP2というタンパク質分解酵素(エンドペプチダーゼ)によって生じること、更にPDモデル動物を用いた解析によって、SENP2阻害剤が脳内における神経変性領域の拡大を効果的に抑制できることが明らかとなりました(Taguchi et al., iScience, 2025;下図2)。今後、新しく発見した標的分子であるSENP2の酵素活性制御による効果的な新規神経保護ストラテジーの構築が期待されます。選択性がより高く、更に効果的なSENP2阻害化合物のスクリーニングを通して、創薬に結実する基礎研究を展開したいと考えています。
※これまでの研究業績は研究者紹介(田口勝敏)およびhttps://researchmap.jp/read0119554 をご覧ください
学部ゼミ
〔前任校(京都府立医科大学 解剖学教室 生体構造科学部門)在籍時の研究配属テーマ(抜粋))〕
|
年度 |
研究テーマ |
|
2023 2022 |
パーキンソン病関連分子αシヌクレインの翻訳後修飾を標的とした神経変性メカニズムの解析 |
|
2021 |
哺乳類脳内におけるαシヌクレインの内在性発現プロファイリング解析 |
|
2019 |
嗅球に高発現するαシヌクレインの機能解析(神経分化における機能について) |
大学院ゼミ
〔修士論文のテーマ〕
神経変性疾患の病理メカニズムに関する研究を中心に展開します。神経変性の基礎研究にご興味を持たれた方は是非、お気軽にご連絡ください。
 大学概要
大学概要
 学部・大学院・専攻科
学部・大学院・専攻科
 学生生活・就職支援
学生生活・就職支援
 研究・地域連携・国際交流
研究・地域連携・国際交流
 入試情報
入試情報