本文
【生命科学コース】研究室活動の紹介(3)-金岡研究室(植物分子遺伝学)
生命科学コースの研究室紹介、第3回目となる今回は植物分子遺伝学研究室(金岡研究室)になります。
植物分子遺伝学研究室(金岡研究室)では、シロイヌナズナ、トマト、ウキクサなどの植物を用いて、生殖や発生に関わる分子メカニズムを調べています。今年度は、研究員が1名、修士2年生が1名、学部4年生が5名、学部3年生が5名、所属しています。今回は研究の様子を簡単に紹介します。
研究室の活動内容についてより詳しく知りたい方は、研究室HPをご覧下さい。また、研究室に興味のある学部生、大学院進学希望者(他大学含む)の研究室訪問も随時受け付けておりますので、メールでお問い合わせ下さい。
最初に紹介するのは、遺伝子のクローニングやコンストラクトの作成の様子です。植物の研究をするといっても、植物だけを扱うわけではありません。遺伝子の機能を調べるために蛍光マーカーと融合させた人工遺伝子を作成して植物に導入して観察したりもします。そのためのコンストラクトを、PCRの手法や大腸菌を用いて作成します。
専用のコンピューターアプリケーションを使って、自分が合成したいコンストラクトの設計図を作成します。

設計図ができたら、そのデザインに従って、PCR法により目的の遺伝子を増やします。ここではPCRの試料を調製しています。

調整した試料をPCR機(サーマルサイクラー)にセットします。数時間で特定のDNA断片が数百万倍に増幅されます。

PCRの待ち時間には電気泳動用のゲルを作成します。まず、メスシリンダーを使って、バッファーを測ります。

アガロースゲルは電子天秤で量ります。

電子レンジでアガロースを溶かします。熱いので突沸に注意して、慎重に作業します。

冷めたゲルは専用のトレーに入れて固めます。

電気泳動槽にゲルを入れ、PCR産物を入れて電気泳動します。

目的のDNAが増えていたら、ゲルからその場所を切り出します。

切り出したゲルからDNAを抽出するために、ゲルをヒートブロックで加熱して溶かします。

遠心分離機で遠心してDNAを回収します。

微量分光光度計を用いて、回収したDNAの濃度や純度を測定します。

増幅したDNAと、あらかじめ用意しておいたプラスミドDNAを連結させて、新しいコンストラクトを作ります。コンストラクトを大腸菌に入れ、選抜のための薬剤が入った培地に播きます。
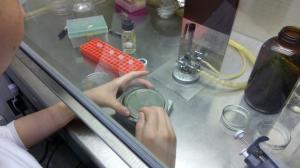
大腸菌はインキュベーターで一晩培養します。

翌日には培地に大腸菌のコロニーが生えてきます。これらのコロニーからプラスミドDNAを単離して、目的のコンストラクトができているか、塩基配列を読んで確認します。

コンストラクトが完成したら、そのプラスミドをアグロバクテリウムという土壌細菌に形質転換します。プラスミドをもたせたアグロバクテリウムを液体培養し、その液の中に植物(ここではシロイヌナズナ)を浸します。するとアグロバクテリウムが植物細胞に感染することにより、目的の遺伝子が植物の染色体の中に組み込まれ、遺伝子組み換え植物が誕生します。

こちらはシロイヌナズナの種子を寒天培地に播いている様子です。無菌状態で育てるため、滅菌した種子をクリーンベンチの中で培地に播きます。

植物が育ったら土に植え替えます。ピンセットで慎重に、幼植物を1個体ずつ摘まみ上げます。

土を入れたポットに幼植物を移し替え、育てます。ここから3週間ほどで花が咲きます。

ここまでは実験室の中でおこなう、分子生物学的な実験を説明しました。次に、フィールドワークの様子を紹介します。

水田やため池にはウキクサが多数生育しています。この中にはこれまでに知られていないような有用な性質を持った個体がいるかもしれません。

水田でウキクサを採集している様子です。

採集したウキクサです。とても小さいですね!今回は3種類のウキクサを採集できました。

研究室に持ち帰ってきたウキクサは、滅菌液に入れて滅菌します。何度か滅菌操作を繰り返して無菌化し、ライン(株)として確立させます。そして成長速度やストレス耐性、代謝産物など、さまざまな形質を測定し、有用な株を探索します。

研究室および教員に関する情報 *より詳しい教育・研究内容は以下をご覧ください。
 大学概要
大学概要
 学部・大学院・専攻科
学部・大学院・専攻科
 学生生活・就職支援
学生生活・就職支援
 研究・地域連携・国際交流
研究・地域連携・国際交流
 入試情報
入試情報